Benzen là 1 trong hợp ý hóa chất thịnh hành, thông thường được sử dụng nhập cuộc sống hằng ngày. Thông qua chuyện nội dung bài viết tại đây, VUIHOC sẽ hỗ trợ những em nắm rõ rộng lớn về benzen hao hao rất có thể giải những dạng bài xích tập luyện áp dụng tương quan rất có thể xuất hiện nay nhập bài xích thi đua.
1. Benzen là gì?
Đầu tiên, tất cả chúng ta hãy nằm trong lên đường nhập lần hiểu hợp ý hóa học cơ học benzen là gì? Về cơ bản, Benzen được nghe biết là 1 trong hidrocacbon thơm phức, lỏng, không tồn tại màu sắc và cũng ko tan nội địa. Khối lượng riêng biệt của benzen nhẹ nhàng rộng lớn đối với nước. Benzen đơn giản và dễ dàng được hòa tan nhập trong trẻo dầu khoáng, dầu động, thực vật, dung môi cơ học,… nhất là cao su đặc, vật liệu bằng nhựa lối, vật liệu bằng nhựa phàn nàn, mỡ, tô, vecni, dầu hắc,…
Bạn đang xem: Benzen Là Gì? Tính Chất Hóa Học, Công Thức Và Đồng Đẳng Của Benzen
Hợp hóa học cơ học benzen rất có thể vào vai trò là dung môi hòa tan được không ít hóa học không giống nữa như: cao su đặc, iot, dầu rán, nến,… Benzen tuy rằng với hương thơm thơm phức nhẹ nhàng tuy nhiên lại cực kỳ tổn hại so với sức mạnh nhân loại.

Trong công nghiệp, benzen là nguyên vật liệu được dùng nhằm tổ hợp rời khỏi thật nhiều hợp ý hóa học cơ học không giống nhau như aniline, clo benzen, nitrobenzen, phenol,... hoặc dùng thực hiện dung môi hòa tan hóa học mỡ.
Tuy nhiên, benzen đã biết thành giới hạn dùng nhập công nghiệp kể từ trong thời hạn 70 của thế kỷ XX. Tại VN, việc cay nghiệt cấm dùng benzen nhập công nghiệp đã và đang được quy quyết định bên trên số 108 LB/QĐ.
2. Công thức tổng quát tháo của benzen
2.1. Cấu tạo ra phân tử của benzen
Benzen (C6H6) cấu trúc bao gồm 6 nguyên vẹn tử C. 6 nguyên vẹn tử này nhập phân tử benzen đều ở hiện trạng lai hóa sp2 (lai hóa tam giác).
Mỗi nguyên vẹn tử C sử dụng 3 obitan lai hóa sẽ tạo link σ với 2 nguyên vẹn tử C ở lân cận nó và tạo ra link với 11 nguyên vẹn tử H.
6 obitan p sót lại của 6 nguyên vẹn tử C tạo thành cấu tạo xen phủ mặt mũi cùng nhau tạo ra trở nên hệ phối hợp π cộng đồng cho tất cả vòng benzen bại liệt. Nhờ vậy nhưng mà link π ở benzen được nghĩ rằng kha khá vững chắc và kiên cố rộng lớn đối với link π ở anken cũng như link π ở những hidrocacbon ko no không giống.
Mô hình phân tử của benzen dạng đặc và trống rỗng như sau:

Biểu thao diễn công thức cấu trúc dạng rút gọn gàng của Benzen:

2.2. Benzen và đồng đẳng
Benzen C6H6 và những hidrocacbon thơm phức không giống với công thức phân tử cộng đồng là CnH2n-6 (n ≥ 6) ví như C7H8 (toluen), C8H10,… lập trở nên một mặt hàng đồng đẳng. C7H8 (toluen), C8H10 vừa vặn là 2 hidrocacbon hàng đầu (không tính số một là benzen) vừa vặn là 2 đồng đẳng bắt gặp tối đa của benzen nhập công tác chất hóa học lớp 11.
Tên gọi cộng đồng của mặt hàng đồng đẳng benzen là aren.
Công thức đơn giản và giản dị nhất nhập mặt hàng đồng đẳng là benzen (C6H6).
Các ankyl benzen thông thường được bắt gặp là toluen C6H5CH3, xilen C6H4(CH3)2, cumen C6H5CH(CH3)2,…
Tham khảo ngay lập tức tư liệu tổ hợp kiến thức và kỹ năng và cách thức giải từng dạng bài xích tập luyện nhập đề thi đua Hóa trung học phổ thông Quốc gia

3. Cách gọi thương hiệu (danh pháp) đồng đẳng, đồng phân của benzen
Khi thay cho thế những nguyên vẹn tử hidro nhập phân tử benzen C6H6 vì chưng những group ankyl không giống nhau, tớ chiếm được những hóa học cơ học ankyl benzen không giống nhau, với công thức cộng đồng là CnH2n-6 với ĐK n ≥ 6, ví như C6H5CH3, C6H5CH2CH2CH3, C6H5CH2CH3,…
Nếu coi vòng benzen là mạch chủ yếu thì những group ankyl gắn nhập nó đó là mạch nhánh, hoặc còn được gọi là group thế. Các ankyl benzen với đồng phân mạch cacbon và tên thường gọi của bọn chúng được người tớ gọi bám theo địa điểm của những nguyên vẹn tử C của vòng vì chưng những kí hiệu vì chưng vần âm o (ortho), m (meta), p (para) hoặc chữ số.
- Tên gọi: Tên địa điểm – thương hiệu nhánh + benzen
Đồng phân của benzen bao gồm 2 loại là đồng phân địa điểm group ankyl nhập cấu tạo vòng benzen và đồng phân mạch cacbon của mạch nhánh.
+ Nếu 2 group thế ở địa điểm 2 C ngay lập tức cạnh nhau tớ chiếm được đồng phân ortho (viết tắt là o-) và C chứa chấp 2 group thế này được khắc số theo thứ tự là 1, 2.
+ Nếu 2 group thế ở địa điểm xa nhau chừng 1 nguyên vẹn tử C (1 đỉnh tam giác) tớ chiếm được đồng phân meta (viết tắt là m-) và C chứa chấp 2 group thế này được khắc số theo thứ tự là một trong, 3.
+ Nếu 2 group thế ở địa điểm 2 nguyên vẹn tử cacbon đối đỉnh cùng nhau (cách nhau 2 nguyên vẹn tử C) tớ chiếm được đồng phân para (viết tắt là p-) và C chứa chấp 2 group thế này được khắc số theo thứ tự là một trong, 4.
Từ C8H10 trở lên đường với những đồng phân về địa điểm kha khá của những group ankyl xung xung quanh vòng benzen và về cấu trúc mạch cacbon của mạch nhánh.
Một số ví dụ về kiểu cách gọi thương hiệu một số trong những đồng đẳng, đồng phân của Benzen

4. Tính hóa học vật lý cơ của benzen và đồng đẳng
Các hidrocacbon thơm phức ở ĐK thông thường tồn bên trên ở dạng hóa học lỏng cực kỳ vui nhộn hoặc ở dạng rắn ở những đồng đẳng cao hơn nữa, bọn chúng với nhiệt độ phỏng sôi tăng theo hướng tăng của lượng phân tử .
Đối với những hidrocacbon thơm phức tồn bên trên ở thể lỏng với hương thơm thơm phức đặc thù, cũng vì thế nguyên do này mà hợp ý hóa học cơ học dạng vòng mang tên gọi là hidrocacbon thơm phức.

Hidrocacbon thơm phức với lượng riêng biệt nhẹ nhàng rộng lớn đối với nước, ko tan nội địa tuy nhiên lại tan nhiều trong số dung môi cơ học như hóa học bự, aceton, rượu, ete,… Benzen (C6H6) đó là một ví dụ nổi bật của đặc điểm vật lí của hidrocacbon thơm phức.
5. Tính hóa chất của benzen và đồng đẳng
5.1. Phản ứng thế của benzen và đồng đẳng
a. Thế nguyên vẹn tử H của vòng benzen
Benzen phản xạ với halogen: benzen + Br2
-
Cho benzen và brom vào trong 1 ống thử thô rồi nhấp lên xuống nhẹ nhàng ống thử.
-
Bổ sung nhập thêm 1 không nhiều bột Fe nhập ống thử bên trên và tổ chức nhấp lên xuống nhẹ nhàng. Ta thấy màu sắc của brom nhạt nhẽo dần dần và thấy với khí hidro bromua bay rời khỏi bởi tiếp tục xẩy ra phản xạ thế:


 Benzen phản xạ với axit nitric: Benzen + HNO3
Benzen phản xạ với axit nitric: Benzen + HNO3


Quy tắc thế: Các ankyl benzen dễ dàng nhập cuộc phản xạ thế nguyên vẹn tử H của vòng benzen rộng lớn benzen và thế sự ưu tiên ở địa điểm ortho (o-) và para (p-) đối với group ankyl.
b) Thế nguyên vẹn tử H ở mạch nhánh
Khi đun toluen hoặc những ankylbenzen với brom tiếp tục xẩy ra phản xạ thế nguyên vẹn tử H của mạch nhánh tương tự động như so với ankan.
VD: Toluen phản xạ với Brom tạo nên Benzyl bromua:

Đăng ký ngay lập tức và để được những thầy cô tư vấn và xây cất suốt thời gian học hành tóm chắc hẳn kiến thức và kỹ năng lớp 10 - 11

5.2. Phản ứng cộng
a) Benzen xẩy ra phản xạ cùng theo với hidro: Benzen + H2
C6H6 + 3 H2 ![small xrightarrow[]{t^{0},Ni}](https://lh3.googleusercontent.com/0C5DDL9rJ6AHAi54YBg-7jsag8aFlDPAAQnH76vnX3xJDn6loJSXkODTOLu_oFzjz6tERbMSKoOxYGtkaCb_ShtcOHalpCIwi_UO7v02F1wvqPAZstcF-u3xnesOAtgMWNAvw_KIu4j2bgUE3g) C6H12 (xiclohexan)
C6H12 (xiclohexan)

b) Benzen phản xạ cùng theo với clo: Benzen + Cl2
Dẫn một lượng nhỏ khí Clo vào trong bình có một không nhiều benzen, che kín lại và đem bình ra bên ngoài tia nắng. Quan sát thấy vào trong bình xuất hiện nay sương white, trở nên bình xuất hiện nay một tờ bột white color, này là hóa học 1,2,3,4,5,6-hexa clo xiclohexan (hexacloran).
Phương trình phản ứng:
C6H6 + 3 Cl2 ![small xrightarrow[]{as'}](https://lh4.googleusercontent.com/ACdr-tAG2DvrqD0yAsKmLQHp-6KE94rHJnVtS2J9eUvcuMy9H9wI6YwItQQVUvsE7Q0drtwX6-XnmITytHnqJTiVCSwEajFHkfKyXB5LTKKcXeQPLz0NYuG0tG9ZSplJbJCQGpI5fppfxgc9cw) C6H6Cl6 (hexacloran)
C6H6Cl6 (hexacloran)

5.3. Phản ứng oxi hóa
a) Phản ứng oxi hoá ko trọn vẹn của benzen và đồng đẳng của benzen
Thí nghiệm:

-
Benzen không khiến mất mặt màu sắc hỗn hợp kali pemanganat KMnO4.
-
Toluen làm cho mất mặt màu sắc hỗn hợp kali pemanganat, tạo nên kết tủa mangan đioxit MnO2.
C6H5-CH3 (toluen) + KMnO4 ![small xrightarrow[]{t^{0}}](https://lh3.googleusercontent.com/RSJTfWKy0Rqx0roiCpFSfEjTxfHSTyUrvbhNYspIeu7uc_40Og7aNUU9B0Uo3iyB-Std2vEHjvPUYiLXmqf8PaGVaMPM2Yw9GKqOE4rhNFs4yAQpyddrVSxkkdP5D4CcIVsHEUQsUYwpdUNX1A) C6H5-COOK (kali benzoat) + 2MnO2↓ + KOH + H2O
C6H5-COOK (kali benzoat) + 2MnO2↓ + KOH + H2O

b) Phản ứng oxi hoá trọn vẹn benzen và đồng đẳng của benzen
Các hiđrocacbon thơm phức Lúc cháy lan nhiều nhiệt độ bám theo phương trình tổng quát tháo sau:
CnH2n-6 + $\frac{3n - 3}{2}$ O2 ![small xrightarrow[]{t^{0}}](https://lh3.googleusercontent.com/3xGX5kwKJNOFTqWz79c7orYeWnJIwlZhKILYHwtBJqV0gYoR50SmszhLcGfW8rDlgwQQCAJEKMxttTaqYHV_3m4zV5s5vYJlc2cc5QFaakDskGuBHuqg4qJ_Yb7gmAkxlsnOiXvlh4QF4eT32w) nCO2 + (n - 3) H2O
nCO2 + (n - 3) H2O
→ Nhận xét: số mol CO2 luôn luôn trực tiếp to hơn số mol H2O
6. Điều chế và phần mềm của benzen
6.1. Điều chế benzen

Cách thịnh hành nhất nhằm pha trộn rời khỏi Benzen là chưng chứa chấp kể từ dầu lửa và vật liệu bằng nhựa phàn nàn đá. Hình như, bọn chúng còn được pha trộn kể từ những ankan hoặc xicloankan. Phương trình phản xạ pha trộn như sau:

6.2. Ứng dụng
Benzen là 1 trong trong mỗi nguyên vật liệu cần thiết nhất của nền công nghiệp hóa cơ học. Nó được phần mềm nhập phát triển polime thực hiện hóa học mềm, cao su đặc, tơ sợi (ví dụ như polistiren, cao su đặc buna-stiren hoặc tơ capron).
Benzen, toluen và những xilen cũng thông thường được dùng để làm thực hiện môi trường xung quanh hoà tan những hóa học như mỡ, cao su đặc, vecni. Benzen còn được sử dụng nhập tẩy mỡ ở xương, domain authority sợi, len, vải vóc, dạ, tẩy mỡ, vệ sinh thô, những tấm sắt kẽm kim loại. Hình như những công cụ với hóa học mỡ bám không sạch cũng khá được tẩy vì chưng benzen.
Từ benzen người tớ pha trộn rời khỏi những hóa học không giống ví như phát triển cumen, axeton, phenol; pha trộn nitrobenzen, anilin, phenol; sử dụng nhập tổ hợp phẩm nhuộm, dược phẩm, dung dịch trừ dịch sợ hãi,…
Toluen được dùng để làm sản xuất dung dịch nổ TNT (trinitrotoluen).

7. Một số bài xích tập luyện về benzen và đồng đẳng của benzen (có điều giải)
Bài tập luyện 1: Hiđrocacbon X là 1 trong hóa học lỏng và với tỉ khối khá đối với không gian vì chưng 3,17. Đốt cháy trọn vẹn hidrocacbon X chiếm được CO2 với lượng vì chưng 4,28 lượt lượng của nước. Tại nhiệt độ phỏng thông thường, X không khiến mất mặt màu sắc hỗn hợp brom tuy nhiên Lúc đun rét (có xúc tác nhiệt độ độ), X làm mất đi màu sắc KMnO4.
a. Hãy lần công thức phân tử và trình diễn công thức cấu trúc của X?
b. Viết những phương trình hoá học tập phản xạ thân mật X với H2 (có xúc tác Ni, đun nóng); với brom (có xúc tác bột Fe); với láo lếu hợp ý axit HNO3 và axit H2SO4 đậm đặc dư.
Đáp án chỉ dẫn giải chi tiết:
a. Gọi CTPT của X là CxHy:
Ta có: MX = 3,17. 29 = 92 ⇒ 12x + hắn = 92 (1)
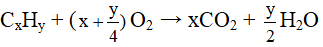
mCO2 = 4,28mH2O ↔ 44x = 4,28. 18. (y/2) ⇒ hắn = 1,14x (2)
Từ (1) và (2) ⇒ x = 7, hắn = 8. CTPT của X là C7H8.
b.

Bài tập luyện 2: Khi triển khai phản xạ tách hidro của 66,25 kilogam etylbenzen chiếm được 52,00 kilogam stiren. Tiến hành phản xạ trùng khớp toàn cỗ lượng stiren này tớ được láo lếu hợp ý A bao gồm với polistiren và cả phần stiren ko nhập cuộc phản xạ. tường 5,đôi mươi gam láo lếu hợp ý A vừa vặn đầy đủ làm mất đi màu sắc của 60,00 ml hỗn hợp brom 0,15M.
a. Hãy tính hiệu suất phản xạ tách hidro của etylbenzen.
b. Tính lượng stiren được trùng khớp.
c. Phân tử khối khoảng của Polistiren vì chưng 3,12.105. Hãy tính thông số trùng khớp khoảng của polime.
Đáp án chỉ dẫn giải chi tiết:

nBr2 = 0,06.0,15 = 0,009(mol)
Theo quyết định luật bảo toàn khối lượng: mA = mstiren = 52,00 (kg) = 52.103 (g)
Theo đề bài xích tớ có: 5,2 g láo lếu hợp ý A ứng dụng vừa vặn đầy đủ với 0,009 mol Br2
⇒ 52.103g láo lếu hợp ý A tiếp tục ứng dụng vừa vặn đầy đủ với 90 mol Br2
Theo (3): nstiren = nBr2 = 90(mol)
mstiren = 90.104 = 9360(g) = 9,36(kg)
Khối lượng stiren tiếp tục nhập cuộc phản xạ trùng khớp = mA - mstiren = 52 - 9,36 = 42,64 (kg)
c. Hệ số trùng khớp là: $n=\frac{312000}{104}=3000$
Bài tập luyện 3: Trình bày những Đặc điểm tương tự và không giống nhau thân mật đặc điểm hoá học tập của stiren với etylbenzen. Viết phương trình hoá học tập nhằm minh họa phản xạ này.
Đáp án chỉ dẫn giải chi tiết:
Tính hóa chất etylbenzen với stiren với những điểm tương tự và không giống nhau như sau:
Giống nhau:

Khác nhau:

Stiren với đặc điểm tương tự với anken:

PAS VUIHOC – GIẢI PHÁP ÔN LUYỆN CÁ NHÂN HÓA
Khóa học tập online ĐẦU TIÊN VÀ DUY NHẤT:
⭐ Xây dựng suốt thời gian học tập kể từ mất mặt gốc cho tới 27+
⭐ Chọn thầy cô, lớp, môn học tập bám theo sở thích
⭐ Tương tác thẳng hai phía nằm trong thầy cô
⭐ Học đến lớp lại cho tới lúc nào hiểu bài xích thì thôi
⭐ Rèn tips tricks chung bức tốc thời hạn thực hiện đề
⭐ Tặng full cỗ tư liệu độc quyền nhập quy trình học tập tập
Xem thêm: Hướng dẫn đo chiều cao, cân nặng để tính chỉ số BMI
Đăng ký học tập demo free ngay!!

Trên đấy là toàn cỗ những vấn đề quan trọng tương quan cho tới lý thuyết của benzen và những đồng đẳng của benzen hao hao một số trong những bài xích tập luyện. Đây là 1 trong phần nội dung cực kỳ cần thiết nhập công tác ôn thi đua ĐH và yên cầu những em nên nắm rõ. Mong rằng kể từ những phần phân tách bên trên, những em tiếp tục rất có thể xây cất buột tay kiến thức và kỹ năng của riêng biệt bản thân. Chúc những em ôn tập luyện chất lượng. Hình như, em rất có thể truy vấn ngay lập tức nhập trang web Vuihoc.vn nhằm được trao tăng nhiều bài xích giảng hoặc tương tác trung tâm tương hỗ và để được chỉ dẫn tăng nhé!