Bạn mến hóa, chúng ta đang được học tập hóa thì chức chúng ta ko thể ko biết cho tới công thức tính thể tích khí ở ddktc, một trong mỗi công thức cự kì cộc gọn gàng và vi diệu. Nó tưởng như đề bài bác cho tới thiếu hụt tuy nhiên lại luôn luôn phải ghi nhận hằng số 22,4.
Bạn đang xem: Công thức tính thể tích khí ở đktc trong Hóa Học - Ehoidap
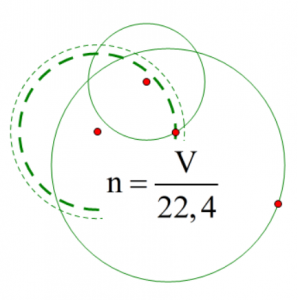
Công thức tính thể tích: $n = \frac{v}{{22,4}}$
- n là số mol
- v là thể tích của hóa học khí ở ĐK tiêu xài chuẩn chỉnh (lít)
Tới phía trên với các bạn sẽ căn vặn ĐK tiêu xài chuẩn chỉnh là gì?
Trả lời: Khi đo 1 đại lượng vật lý cơ vô chống thử nghiệm người tao quan hoài cho tới sức nóng chừng và áp suất. Nếu sức nóng chừng là 00C (hay 273,15 chừng K) và áp suất là một trong atm (hay 100 kPa) thì => sức nóng chừng tiêu xài chuẩn chỉnh và áp suất tiêu xài chuẩn chỉnh => Gọi là ĐK tiêu xài chuẩn chỉnh.
Ví dụ 1. Người tao pha chế N2 vô chống thử nghiệm theo gót phản xạ NH4NO3 → N2 + 2H2O. Khí N2 nhận được ở ĐK tiêu xài chuẩn chỉnh là 22,4 lít. Hãy tìm
a) số mol khí N2 nhận được.
b) Khối lượng NH4NO3.
Hướng dẫn giải
Theo công thức tính thể tích khí ở đktc thì $n = \frac{v}{{22,4}} = \frac{{22,4}}{{22,4}} = 1\left( {mol} \right)$
a) Số mol khí N2 nhận được n = 1 mol
b) Theo phản xạ thì số mol NH4NO3 = số mol khí N2.
Khối lượng NH4NO3: $m = n.{A_{N{H_4}N{O_3}}}$$ = 1.\left( {7 + 1.4 + 7 + 8.3} \right)$$ = 42\left( {g} \right)$
Xem thêm: Viên Uống Bổ Trứng Blackmores Tăng Khả Năng Thụ Thai Có Tốt Không? Có Dễ Thụ Thai?
Ví dụ 2. Thả miếng thông thường vô hỗn hợp axit sunfuric thì thấy khí H2 cất cánh nên. Người tao đo được lượng khí nhận được ở ĐK tiêu xài chuẩn chỉnh là V = 11,2 lít. Hãy
a) Viết phương trình phản ứng
b) Tính lượng hóa học tan nhằm nhận được lượng khí trên
c) Trong thử nghiệm, người tao chỉ nhận được 30% lượng khí H2 bay nên đối với khí thực sinh rời khỏi kể từ phản xạ. Hỏi lượng hóa học tam rước phản xạ là bao nhiêu?
Hướng dẫn giải
a) Theo đề bài bác, tao với phản ứng: Zn + H2SO4 → ZnSO4 + H2↑
b) Vì hóa học khid được đo ở đktc nên số mol nhận được được $n = \frac{v}{{22,4}} = \frac{{11,2}}{{22,4}} = 0,5\left( {mol} \right)$
Theo phản xạ nZn = nH2 = 0,5 (mol) => mZn = nZn.AZn = 0,5.65 = 32,5(g)
c) Thể tích V = 11,2 lít chỉ chiếm khoảng chừng 30% lượng khí thực => số thể tích thực nhận được là V’ = 11,2 : 30% = $\frac{{112}}{3}$ lít
Xem thêm: Lợi ích sức khỏe từ cải thìa: Ai nên ăn thường xuyên?
Số mol khí nhận được là $n = \frac{{V’}}{{22,4}}$$ = \frac{{\frac{{112}}{3}}}{{22,4}}$$ = \frac{5}{3}\left( {mol} \right)$
Khối lượng Zn rước nhập cuộc phản ứng: m’ = n’.A = $\frac{5}{3}.65 = 108,333\left( g \right)$
Tài liệu thầy Hồ Thức Thuận: LINK TẢI ĐỀ – LINK TẢI ĐÁP ÁN












Bình luận