Trong môn chất hóa học, việc nắm rõ công thức tính độ đậm đặc Xác Suất, độ đậm đặc mol đó là khóa xe canh ty chúng ta học viên hoàn toàn có thể đoạt được từng vấn đề kể từ dễ dàng cho tới khó khăn. Chính vậy nên đấy là những kỹ năng và kiến thức vô nằm trong cần thiết. Trong nội dung bài viết này, hãy nằm trong LabVIETCHEM đi tìm kiếm hiểu về những tính độ đậm đặc mol, độ đậm đặc Xác Suất và cút vô giải một vài bài xích luyện minh họa ví dụ, để giúp đỡ chúng ta gia tăng kỹ năng và kiến thức, sẵn sàng hành trang thiệt đảm bảo chất lượng mang đến năm học tập mới mẻ.

Bạn đang xem: Công thức tính nồng độ phần trăm (C%) nồng độ mol Bài tập + Lời giải
Công thức tính C% và công thức tính độ đậm đặc mol
Nồng phỏng là gì?
Nồng phỏng là định nghĩa nhằm biểu thị lượng hóa hóa học với vô một lếu láo thích hợp, đa số là hỗn hợp. Một số định nghĩa độ đậm đặc hoặc gặp gỡ là:
- Nồng phỏng phần trăm
- Nồng phỏng mol
- Nồng phỏng molan: Biểu thị số mol của một hóa học mang đến trước vô 1kg dung môi
- Nồng phỏng chuẩn: Thường người sử dụng mang đến những phản xạ và hỗn hợp axit – bazo
- Nồng phỏng chủ yếu tắc: Là cơ hội đo độ đậm đặc tương tự động như độ đậm đặc mol và không nhiều Lúc dùng
Nồng phỏng Xác Suất là gì?
Nồng phỏng Xác Suất biểu thị số gam hóa học tan với vô 100g hỗn hợp và được ký hiệu là C%.
1. Công thức tính độ đậm đặc phần trăm
Qua nghiên cứu và phân tích và demo nghiệm những Chuyên Viên đã mang ra sức thức tính độ đậm đặc Xác Suất đúng đắn nhất.
Công thức tính C% vô hóa học:

Trong đó:
- C%: Ký hiệu của độ đậm đặc phần trăm
- mct: Ký hiệu của lượng hóa học tan
- mdd: Ký hiệu của lượng dung dịch
Công thức tính mdd:
mdd = mct + mdm (trong cơ mdm là lượng của dung môi)
2. Các bước giải bài xích thói quen độ đậm đặc phần trăm
Các dạng bài xích thói quen độ đậm đặc Xác Suất vô chất hóa học cực kỳ đa dạng và phong phú, tuy nhiên bọn chúng đều nên tiến hành giải theo đuổi công việc sau đây:
- Bước 1: Khi gọi đề bài xích tất cả chúng ta rất cần được xác lập được số hóa học với vô hỗn hợp, nhất là những số dư của hóa học nhập cuộc phản xạ.
- Bước 2: Tính lượng hỗn hợp sau thời điểm nhập cuộc phảm ứng theo đuổi cách thức bảo toàn lượng (tổng lượng hóa học nhập cuộc phản xạ = tổng lượng sản phẩm).
- Bước 3: Tính mct
- Bước 4: gí dụng công thức tính độ đậm đặc Xác Suất nhằm xử lý vấn đề.
Áp dụng trúng 4 bước bên trên đấy là chúng ta trọn vẹn hoàn toàn có thể tính độ đậm đặc Xác Suất rồi. Tuy nhiên, có khá nhiều bài xích luyện nó ko mang đến sẵn lượng của những hóa học nên tớ rất cần được vận dụng những kỹ năng và kiến thức chất hóa học và được học tập kết phù hợp với công thức tính độ đậm đặc Xác Suất nhằm giải vấn đề nhé.
Bài thói quen độ đậm đặc Xác Suất của dung dịch
Bài 1: quý khách hàng hãy tính lượng của NaOH với vô 200g hỗn hợp NaOH 15%
Lời giải:
Áp dụng công thức C% = (mct/mdd).100% tớ có:
C% = (mNaOH/200).100 = 15 (%)
=> mNaOH = (15.200)/100 = 30 (g)
Trong đó:
- (.) ký hiệu vệt nhân
- (/) ký hiệu vệt chia
Kết luận: Vậy vô 200g hỗn hợp NaOH 15% với 30 gam NaOH
Bài 2: Tiến hành hòa tan trăng tròn gam muối bột vô nước nhận được hỗn hợp A với C% = 10%
a, Hãy tính lượng của hỗn hợp A thu được
b, Hãy ính lượng nước quan trọng cho việc trộn chế
Lời giải:
a, gí dụng công thức C% = (mct/mdd).100% tớ có:
mdd=(mmuối.100)/ C% = (20.100)/10 = 200 gam
Kết luận: Vậy lượng hỗn hợp A là 200 gam
b, gí dụng cách thức bảo toàn lượng tớ có mnước=mdd - mmuối = 200 - trăng tròn = 180 gam
Kết luận: Vậy nhằm hoàn toàn có thể trả tan trăng tròn gam muối bột thì tất cả chúng ta nên cần thiết 180 gam nước muốn tạo đi ra 200 gam dung dịch
Bài 3: Tiến hành hòa tan 3,9 gam Kali vô 36,2 gam nước tất cả chúng ta nhận được hỗn hợp B với độ đậm đặc bao nhiêu?
Lời giải:
Ta với phương trình phản xạ chất hóa học sau
2K + 2H2O -----> 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo cân đối phương trình tớ tính được:
mdd = mk + mH2O - mH2 = 3,9 + 36,2 - (0,05.2) = 40 gam
=> gí dụng công thức C% = (mct/mdd).100% tớ với C% = [(0,1.56)/40].100% = 14%
Kết luận: Khi tổ chức hòa tan 3,9 gam Kali vô 36,2 gam nước đi ra tiếp tục nhận được hỗn hợp với độ đậm đặc 14%.
Bài 4: Hòa tan 10 gam lối vô 40 gam nước. Hãy tính độ đậm đặc Xác Suất của hỗn hợp nhận được theo đuổi đơn vị chức năng %?
Lời giải:
Khối lượng của hỗn hợp là:
mdd = mdm + mct = 10 +40 = 50 gam
Nồng phỏng Xác Suất là:
C% = (mct/cdd) . 100% = (10/50). 100% = 20%
Vậy độ đậm đặc Xác Suất của hỗn hợp nhận được sau phản xạ là 20%.
Bài 5: Dung dịch HCl với độ đậm đặc là 36%. Tính lượng HCl với vô 200g dung dịch
Lời giải:
Xem thêm: 6 khác biệt giữa nước mắm truyền thống và nước mắm công nghiệp
Nồng phỏng phần trăn hỗn hợp là:
C% = mct/mdd . 100%
=> mct = (C%.mdd)/100%
Vậy lượng hóa học tan HCL là: mHCl = (36%.200)/100% = 72 gam.
=> Các bài xích luyện về => Phương trình nhiệt độ phân KClO3 (muối Kali Clorat)
Một số chú ý Lúc tính độ đậm đặc Xác Suất của dung dịch
- Phải gọi đề kĩ nhằm hiểu rằng đúng đắn những bộ phận tiếp tục mang đến, xác lập được cần thiết đo lường và tính toán những bộ phận nào là.
- gí dụng trúng công thức tính nhằm tách những sai lầm không mong muốn ko quan trọng.
- Tính những tài liệu nên cảnh giác, tách những sơ sót ko xứng đáng với.
Nồng phỏng mol không giống độ đậm đặc Xác Suất như vậy nào?
Nồng phỏng Mol là gì?
Nồng phỏng mol của hỗn hợp mang đến tất cả chúng ta biết số mol hóa học tan với trong một lít hỗn hợp là từng nào.
Công thức tính độ đậm đặc mol
Ngoài công thức tính độ đậm đặc Xác Suất thì công thức tính độ đậm đặc mol cũng khá cần thiết và xuất hiện nay nhiều trong số bài xích luyện.
1. Công thức tính độ đậm đặc mol theo đuổi khối lượng
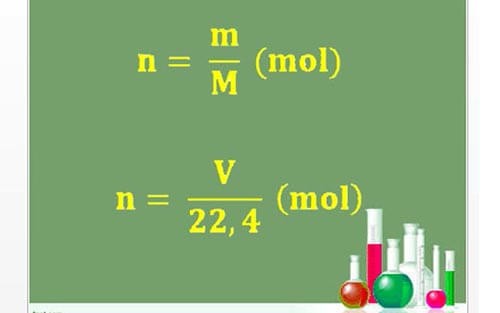
Trong đó:
- n: ký hiệu số mol
- m: lượng của hóa học đó
- M: Khối lượng mol của hóa học cơ (có sẵn vô bảng tuần trả hóa học)
- V: Thể tích (đktc)
2. Cách tính độ đậm đặc mol
Nồng phỏng mol với ký hiệu là CM và được xem theo đuổi công thức
CM=n/Vdd
- CM: ký hiệu của độ đậm đặc mol
- n: Ký hiệu số mol hóa học tan
- V: Ký hiệu thể tích dung dịch
3. Bài thói quen độ đậm đặc mol
Bài 1: 16 gam NaOH với vô 200 ml hỗn hợp, hãy tính độ đậm đặc mol của dung dịch
Lời giải:
- Ta thay đổi 200 ml = 0,2 lít
- nNaOH = 16/ 40 = 0,4 mol
=> gí dụng công thức tính độ đậm đặc mol CM=n/Vdd tớ có
CM = n/ V = 0,4/ 0,2 = 2M
Kết luận: Nồng phỏng mol của hỗn hợp là 2M
Bài 2: Hãy tính lượng H2SO4 với vô 50 ml hỗn hợp H2SO4 2M
Lời giải:
Áp dụng công thức tính độ đậm đặc mol CM=n/Vdd tớ có
nH2SO4 = CM.V = 0,1 mol
=> mH2SO4 = 0,1.98 = 98 gam
Kết luận: Trong 50 ml hỗn hợp H2SO4 với 98 gam H2SO4 .
Bài 3: Hãy tính lượng hóa học tan cần thiết dùng làm điều chế 2,5 lít hỗn hợp NaCl 0,9M
Lời giải:
Áp dụng công thức tính độ đậm đặc mol CM=n/Vdd tớ có
nNaCl = CM.V = 2,5 . 0,9 = 2,25 mol
=> mNaCl = 2,25 . (23 + 35,5)= 131,625 gam
Bài 4: Hãy tính số mol và số gam hóa học tan tỏng 1 lít hỗn hợp NaCl 0,5M
Lời giải:
Vdd = 1 lít, CM = 0,5M
=> nNaCl = CM.V = 1. 0,5 = 0,5 mol
=> mNaCl = m = n.MNaCl = 0,5 . (23 + 35,5)= 29,25 gam
Mối mối liên hệ thân mật độ đậm đặc Xác Suất và những độ đậm đặc hỗn hợp khác
Giữa độ đậm đặc Xác Suất và độ đậm đặc mol
CM = (10 x d x C%) / M
Trong đó:
- M: lượng phân tử hóa học tan.
- CM: độ đậm đặc mol của hỗn hợp.
- d: lượng riêng rẽ của hỗn hợp.
- C%: nồng phỏng phần trăm của hỗn hợp.
Giữa độ đậm đặc Xác Suất và độ đậm đặc đương lượng
Đương lượng là đơn vị chức năng được dùng nhằm đo lường và tính toán kỹ năng 1 hóa học kết phù hợp với 1 hóa học không giống. Nồng phỏng đương lượng biểu thị số đương lượng gam hóa học tan chứa chấp vô 1l hỗn hợp. Công thức đối sánh tương quan thân mật độ đậm đặc đương lượng và độ đậm đặc Xác Suất được màn biểu diễn như sau:
CN = (10 x d x C%) / D
Trong đó:
- D: đương lượng gam
- d : lượng riêng rẽ của hỗn hợp.
- CN: độ đậm đặc tương tự của dung dịch
- C%: nồng phỏng phần trăm của hỗn hợp.
Tính toán tỷ trọng Xác Suất luyện trung
- Tỷ lệ Xác Suất độ đậm đặc mang đến tớ biết với từng nào bộ phận hoạt hóa học ví dụ với vô hoặc rất cần được với vô một biện pháp tổng thể nào là cơ.
- bằng phẳng cơ hội đặt điều số loại nhất lên bên trên số loại nhị, độ đậm đặc Xác Suất được biểu thị là 1:100, 1:200,… hoàn toàn có thể quy đổi trở thành 1 phần.
- Trong 1 phần Solute (thuốc) với 100 phần mẻ, 1/100 dung môi.
Hy vọng chúng ta học viên hoàn toàn có thể ghi lưu giữ được công thức tính độ đậm đặc phần trăm (C%) và công thức tính độ đậm đặc mol (CM) và đạt thành phẩm đảm bảo chất lượng vô kỳ ganh đua. Tham khảo thêm thắt nhiều công thức chất hóa học không giống bên trên trang web fgate.com.vn.
Xem thêm: Lợi ích sức khỏe từ cải thìa: Ai nên ăn thường xuyên?
XEM THÊM:
>>> Cách tính đương lượng và quyết định luật đương lượng vô hóa học
Tìm kiếm:
- công thức quy đổi độ đậm đặc mol thanh lịch độ đậm đặc phần trăm
- tính độ đậm đặc Xác Suất những hóa học vô hỗn hợp sau phản ứng
- bài thói quen độ đậm đặc Xác Suất lớp 9 với Lời giải












Bình luận